生命科学与技术学院刘文强/高绍荣/魏珂/王译萱团队利用新型双向潜能干细胞实现小鼠器官发生初期胚胎发育高效模拟,成果发表于《细胞研究》
来源:生命科学与技术学院
时间:2025-09-02 浏览:
胚胎植入子宫后,通过原肠运动建立内胚层、中胚层、外胚层三胚层结构,进而启动神经管闭合、体节形成等过程,并奠定心脏等器官发育的基础。这一系列事件对胚胎着床、器官发生及胎儿发育具有决定性作用。胚胎干细胞(ESCs)、胚外内胚层干细胞(XEN)和滋养层干细胞(TSCs)的建立,为研究早期胚胎谱系分化提供了重要工具。在此基础上发展的干细胞类胚胎模型技术,通过多种干细胞的自组装,在体外重现了早期胚胎发育与器官发生过程,为解析发育机制和疾病成因提供了新范式。
然而,当前构建模拟小鼠原肠胚形成后阶段的类胚胎模型,仍需依赖胚内(ESCs、XEN)和胚外(TSCs)多种干细胞系或转基因操作,存在培养体系复杂、效率低下的瓶颈,严重限制了该技术的应用。因此,突破胚内-胚外谱系分化的壁垒,建立具有双向分化潜能且能长期稳定培养的新型干细胞,并实现高效的原肠后类胚胎构建,将成为推动发育生物学和再生医学发展的关键突破。
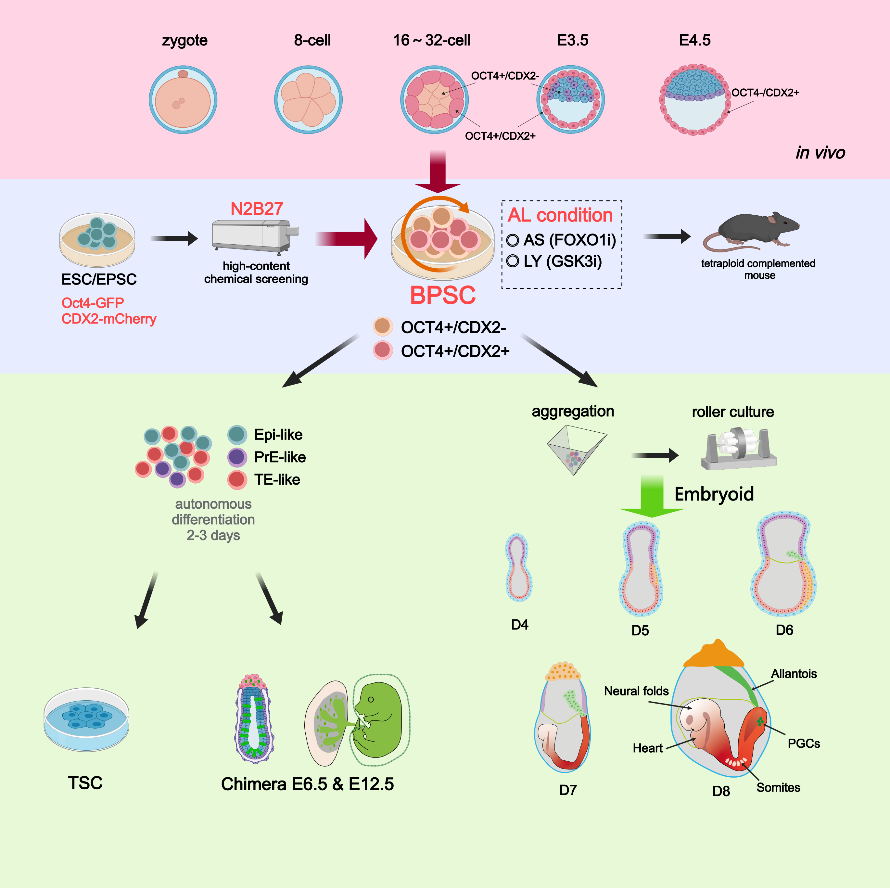
8月29日,生命科学与技术学院高绍荣院士团队与魏珂教授团队在《细胞研究》(Cell Research)期刊上发表题为“Modeling Post-Gastrula Development via Bidirectional Pluripotent Stem Cells”的研究论文。该研究通过高内涵筛选,成功建立了一种可在体外长期培养的具有胚外-胚内双向分化能力的新型干细胞(Bidirectional Pluripotent Stem Cells,BPSCs)。该类细胞同时表达OCT4和CDX2,并且能在体外不添加诱导培养基的情况下,高效自发分化为三类早期胚胎谱系(Epi、TE和PrE)。BPSCs展现出强大的类胚胎形成能力,能够高效精确重现小鼠胚胎心脏跳动、神经管闭合、体节形成及原始生殖细胞迁移等一系列关键发育事件。该项工作为再现着床后胚胎发育提供了新的细胞平台,也为研究早期人类发育与再生医学奠定了基础。

研究团队首先利用带有Oct4-GFP和CDX2-mCherry双重荧光报告基因的扩展多能干细胞(EPSCs)进行小分子筛选,在1859种小分子中发现AS1842856(FOXO1抑制剂)和LY2090314(GSK3抑制剂)这两种小分子能够共同诱导超过70%的细胞呈现OCT4和CDX2双阳性表达状态。此类细胞在AL培养条件下可以长期稳定培养,并且EPSCs也可从桑葚胚时期直接建立(图1)。通过单细胞转录组分析发现BPSCs更靠近处于第一次命运决定期的8至16-细胞期胚胎。此外,四倍体补偿实验证明BPSCs具有独立支持完整胚胎发育至成年的潜能。
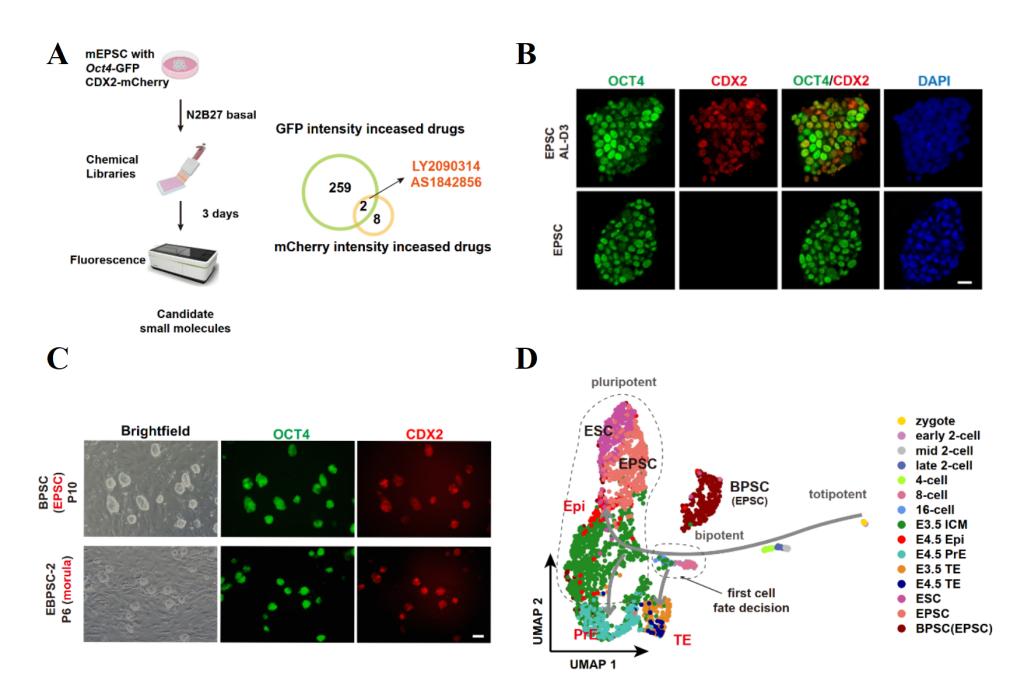
图1、BPSCs的建立
在体外自由分化实验中,研究团队进一步证明BPSCs可以在仅使用没有额外诱导因子的基础培养基条件下,于48小时内分化出CDX2阳性(33.6%)、OCT4阳性(40.9%)及GATA6阳性(8.6%)的三类细胞,三者分别对应E4.5阶段囊胚中的三大谱系。这种无需诱导即可分化为三谱系的能力验证了BPSCs具备的高度可塑性(图2)。
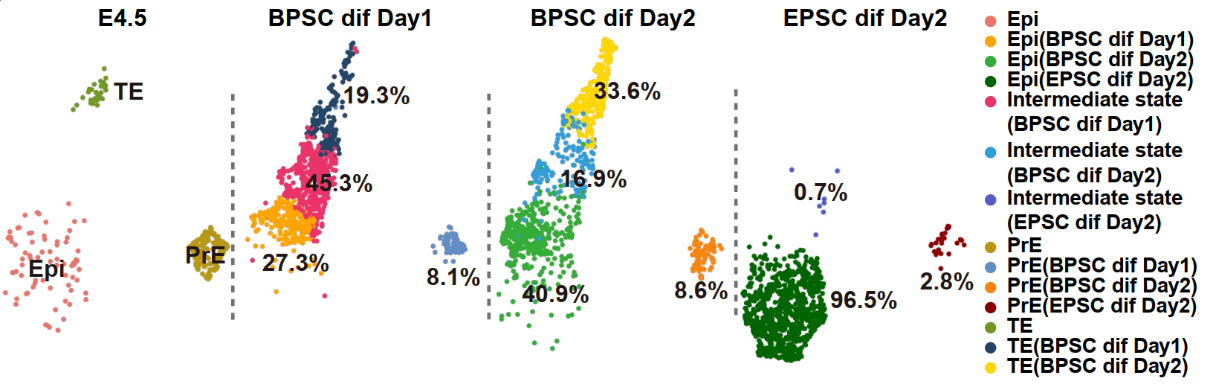
图2、BPSCs在无诱导因子条件下自发分化
更为关键的是,研究团队利用这一培养体系,在仅使用化学诱导的条件下,从单一细胞起始实现了对E8.5-E8.75器官形成阶段胚胎发育的精确模拟。在数日的体外培养中,BPSCs类胚胎逐渐完成了卵黄囊血岛产生、头神经褶发育、神经管形成与闭合、心脏有规律的搏动、体节形成、原始生殖细胞的产生和迁移等多个重要发育事件。免疫荧光与单细胞转录组分析显示,所构建的类胚胎结构在形态结构与细胞组成上与自然胚胎(E8.5-E8.75)高度一致,具备复杂且精细的组织结构。
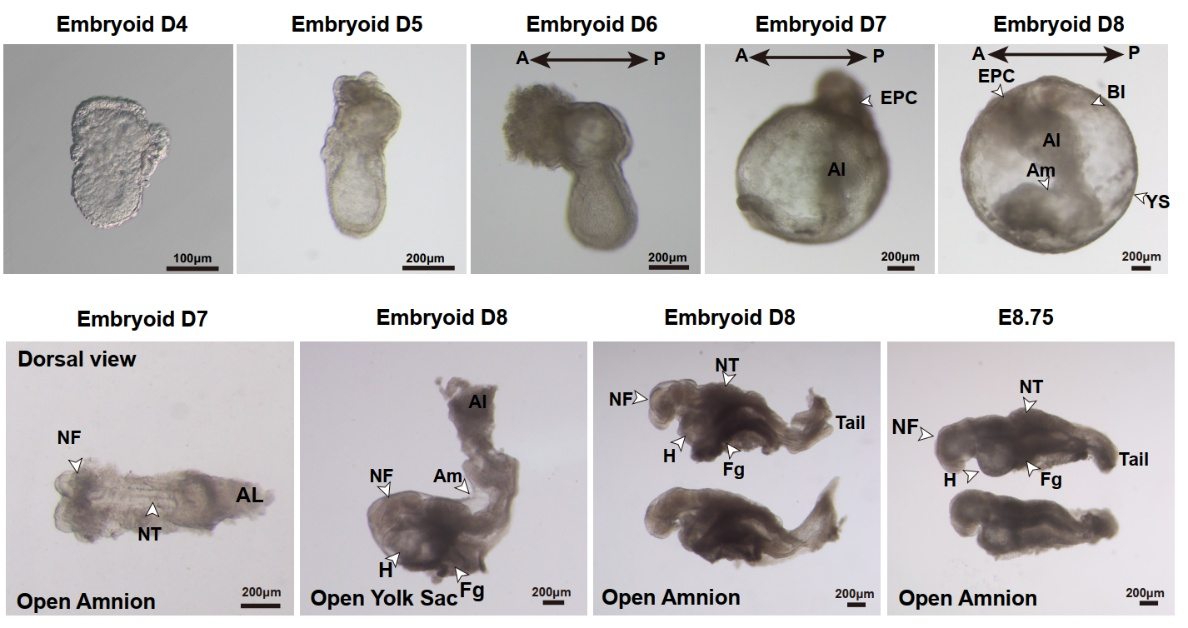
图3、单一细胞起始构建器官发生初期类胚胎
BPSCs中胚外谱系相关基因CDX2、TFAP2C等启动子区域相比其它干细胞呈现更加开放状态,H3K27ac等激活性表观标志明显增强,这为其分化为胚胎外谱系提供了表观基础。在机制上,研究证明Wnt通路的超激活可通过转录因子LEF1上调CDX2的表达。同时在胚胎中敲低LEF1可导致囊胚形成受到抑制,揭示LEF1在体内同样具有调控胚外谱系细胞命运决定的重要作用。
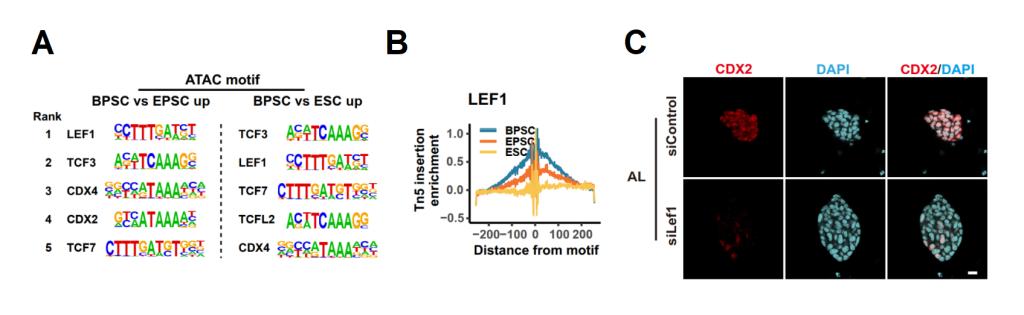
图4、lef1负责激活BPSCs的胚外发育潜能
更值得关注的是,该研究成功验证了AL培养体系在人类干细胞中的普适性。当研究人员将相同的小分子组合(AS与LY)添加到人类naïve多能干细胞(naïve ESCs)中,仅数日处理便诱导出OCT4/CDX2双阳性细胞状态。单细胞RNA测序进一步证实,这些人源细胞同步激活了滋养层发育相关基因网络。提示,BPSCs培养体系在跨物种应用及人类胚胎发育研究中均具备重要的拓展价值。
生命科学与技术学院、同济大学附属妇产科医院助理研究员刘奎升、博士研究生燕子回、助理研究员柏丹丹、博士研究生姜睿、毕焱副教授、博士研究生马祥钧为论文共同第一作者,同济大学附属妇产科医院刘文强教授、生命科学与技术学院高绍荣院士、魏珂教授、王译萱教授为论文共同通讯作者。该研究得到国家重点研发计划和国家自然科学基金等项目资助。
论文链接:https://www.nature.com/articles/s41422-025-01172-x